 2022-07-09
2022-07-09
实验室建设与管理


一、分析方法验证的目的
什么是分析方法验证?
分析方法验证是由药品的开发者或使用者来检验其方法是否达到预期的可靠性、准确度和精密度的过
程。——CDRE评审指南《色谱分析方法的验证》
为什么要进行分析方法验证?
分析方法验证的目的是为了阐述分析方法适用于分析目的;
——ICH Q2(R1)
药品质量标准分析方法验证的目的是证明建立的方法适用于相应的检验要求;
——ChP 2020 <9101>
分析方法验证是对分析方法整个生命周期过程中适用性的评估,以保证方法的准确、可靠,其最终目的
是能够满足产业化需求。

二、分析方法验证的流程
验证前准备
预验证:
预验证是制定验证方案具体参数及限度范围的重要依据,规避验证偏差。
预验证建议确定的参数:
验证样品的浓度水平(高、中、低水平;线性范围;检出限、定量限预期浓度);
样品前处理适用情况(影响精密度和重复性);
试剂及对照品的级别;
不同分析仪器的适用情况;
不同耗材的耐用性(色谱柱、薄层板、微孔滤膜等);
验证方案起草
在正式验证开始前,应根据预验证结果起草分析方法验证方案,验证方案作为验证依据的必要文件需要
进行审批,审批后的方案不可随意更改;
验证方案的内容
三、分析方法验证的设计
GMP要求
CFDA GMP
第十二条 质量控制的基本要求:(四)检验方法应当经过验证或确认;
第二百二十三条 物料和不同生产阶段产品的检验应当至少符合以下要求:(二)符合下列情形之一的,
应当对检验方法进行验证:1.采用新的检验方法;2.检验方法需变更的;3.采用《中华人民共和国药典》
及其他法定标准未收载的检验方法;4.法规规定的其他需要验证的检验方法。(三)对不需要进行验证
的检验方法,企业应当对检验方法进行确认,以确保检验数据准确、可靠;
EU GMP
6.15 分析方法应当经过验证。上市许可文件中描述的检验操作应当按照批准的方法来实施。
EU GMP附录15 确认与验证
8.1应对所有在确认、验证或清洁实践中所使用的分析方法进行验证,并规定适当的检测限与定量限,如
需要可按照《欧盟GMP指南》第I部分第6章中所描述进行。
8.2 当实施对产品的微生物检测时,其方法应经过验证,以确保检测产品不影响结果。
CFR 211
CFR 211.165(e):应建立所使用分析方法的准确性、选择性、专属性和重现性并记录,该方法验证及验证文件应达到211.194(a)(2)的要求。
指南
中国药典 9101 分析方法验证指导原则
美国药典 1225 药典规程的验证
美国药典 1226 药典规程的确认
美国药典 1244 分析方法转移
FDA 工业指南 药品和生物制品分析规程及方法验证
ICH(人用药品注册技术要求国际协调会)Q2(R1) 分析方法验证
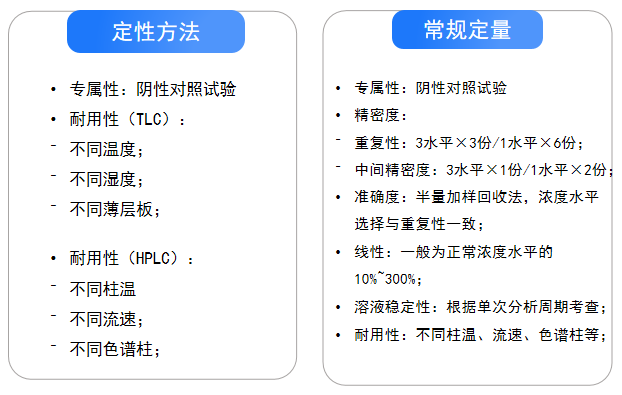
根据分析方法的不同,验证项目大多不同,大致分为定性方法、常量测定方法、限度检查方法及微量测
定方法等4种,不同的方法验证的设计思路不同。
四、分析方法验证各个项目的意义
专属性
专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测
物的能力。鉴别反应、杂质检查和含量测定方法,均应考察其专属性。如方法专属性不强,应采用一种
或多种不同原理的方法予以补充。
准确度
准确度系指用所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示。准确度
应在规定的线性范围内试验。准确度也可由所测定的精密度、线性和专属性推算出来。
精密度
精密度系指在规定的测定条件下,同一份均匀供试品,经多次取样测定所得结果之间的接近程度。精密
度一般用偏差、标准偏差或相对标准偏差表示。
在相同条件下,由同一个分析人员测定所得结果的精密度称为重复性;在同一实验室内的条件改变,如
不同时间、不同分析人员、不同设备等测定结果之间的精密度,称为中间精密度;不同实验室测定结果
之间的精密度,称为重现性。
检测限
检测限系指试样中被测物能被检测出的最低量。检测限仅作为限度试验指标和定性鉴别的依据,没有定
量意义。
定量限
定量限系指试样中被测物能被定量测定的最低量,其测定结果应符合准确度和精密度要求。对微量或痕
量药物分析、定量测定药物杂质和降解产物时,应确定方法的定量限。
线性
线性系指在设计的范围内,线性试验结果与试样中被测物浓度直接呈比例关系的能力。
范围
范围系指分析方法能达到精密度、准确度和线性要求时的高低限浓度或量的区间。
耐用性
耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度,为所建立的方法用于常规检验提
供依据。
五、分析方法验证与确认的区别
方法验证:是指在标准方法或者非标方法在引入实验室使用前,对实验室从人、机、料、法、环、测等
方面评定其是否有能力在满足方法要求的情况下开展检测校准活动的过程。
方法确认:是对非标准方法,实验室制定的方法,超出预定范围使用的标准方法或其它修改的标准方法
确认能否合理,合法使用的过程。


一、微生物基础知识
微生物个体微小,与人类关系密切,常见的微生物包括细菌、真菌、病毒等,其中细菌根据细胞壁组成
不同又可分为革兰氏阳性菌和革兰氏阴性菌等大类。
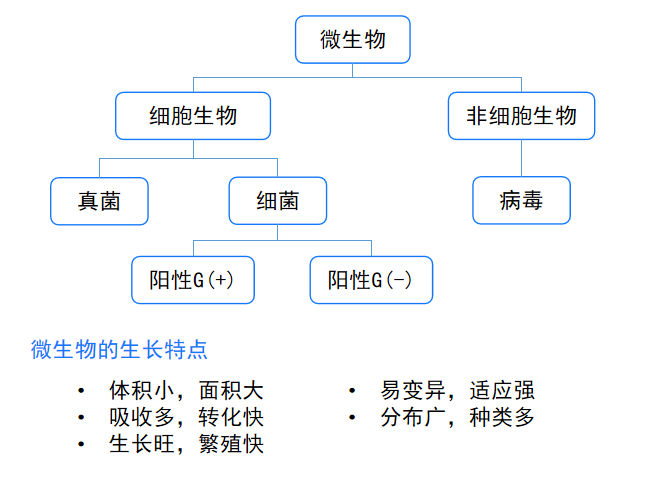
检验中常见的微生物:大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、沙门氏菌、白色念珠球菌。
二、药品检验中微生物的特性
微生物的生存和繁殖与环境的温湿度有很大关系,因此温湿度的管理对于样品中微生物的繁殖起到关键
作用,微生物检验过程中可以利用温湿度条件对微生物进行培养増菌或杀灭。

三、非无菌药品微生物的检验
微生物限度检查法系检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。检查项目包括细菌
数、霉菌数、酵母菌数及控制菌检查。

四、消毒与灭菌
灭菌是指采用强烈的理化因素使任何物体内外部的一切微生物永远丧失其生长繁殖能力的措施,而消毒
是指杀死病原微生物,二者差异在于消毒无法杀灭芽孢。
