 2022-11-02
2022-11-02

(一)基本情况概述
1:产品名称、编号、规格、包装规格等
2:回顾期限:XXXX年X月X日-XXXX年X月X日
3:产品生产总批次、批量、收率
(二)原辅材料回顾
1:需描述主要原辅料、内包材供应商情况
2:购进情况、批次以及质量检验情况
3:质量检查内容主要包括但不局限于
4:对物料的投诉情况进行回顾性描述,汇总描述投诉内容以及处理方法
5:对物料使用是否影响产品质量进行综合分析评价
6:新增加的原辅料、药包材供应商提供的物料,应单独进行统计描述
(三)生产过程工艺控制
1:统计分析关键工艺参数:中间体、物料平衡收率
2:可以根据列表、作图描述每项参数的范围,如温度控制范围(5-10℃).通过统计确定规定时间内产品批次控制数值是否在合理限度内,对不合格情况应进行详细描述。
(四)成品检验结果分析
(五)OOS审核
统计OOS情况,调查原因,最终结果,所采取的处理措施及预防纠正措施
(六)偏差审核
1:包括所有重大偏差以及相关的调查和所采取的整改措施
2:可将偏差发生率与往年数据进行对比,对发生偏差的趋势及重复发生偏差的产生原因进行分析,评价CAPA的有效性
(七)返工及不合格品情况
(八)变更审核
(九)稳定性数据分析
1:稳定性数据分析是产品判定工艺稳定性以及是否处于受控状态的一个关键性指标
2:加速稳定性数据和长期稳定性数据
3:工艺验证批次的长期稳定性数据
4:对产品质量有影响的变更发生后的产品进行稳定性数据分析
5:回顾稳定性考察批次、储藏条件、考察目的、结果,对已结束的稳定性考察课汇总完成已考察的月份
6:回顾期间稳定性数据批次及选择这些批次的原因
7:对稳定性数据结果趋势分析情况进行分析
8:产品稳定性数据和趋势分析(回顾期间的完成的稳定性试验数据)
(十)药品注册信息
(十一)验证状态确认
(十二)委托生产、检验情况
(十三)CAPA管理审核
上年度回顾报告中的纠正预防措施执行结果确认,根据产品质量情况和偏差情况,已评价CAPA实施的有效性
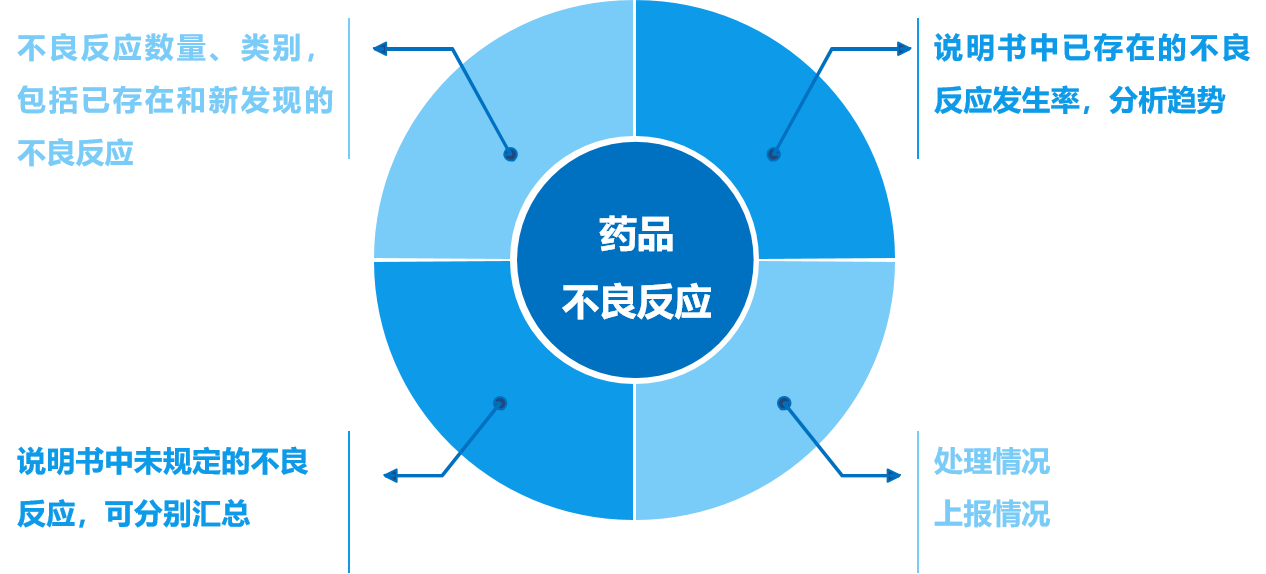
(十四)药品不良反应情况
(十五)投诉、退货以及产品召回
(十六)结论回顾
1:结论回顾分析包括
2:上年度质量回顾中建议的整改和预防措施的实施情况
3:提出是否需要采取纠正和预防措施或进行再确认或再验证的评估意见及理由,并及时、有效地完成整改