 2023-09-20
2023-09-20
美国食品药品监督管理局(FDA)在2023年3月对一家名为“Cosmobeauti Laboratories & Manufacturing Inc.”的公司场地进行检查后,于同年8月向其签发了一封警告信。
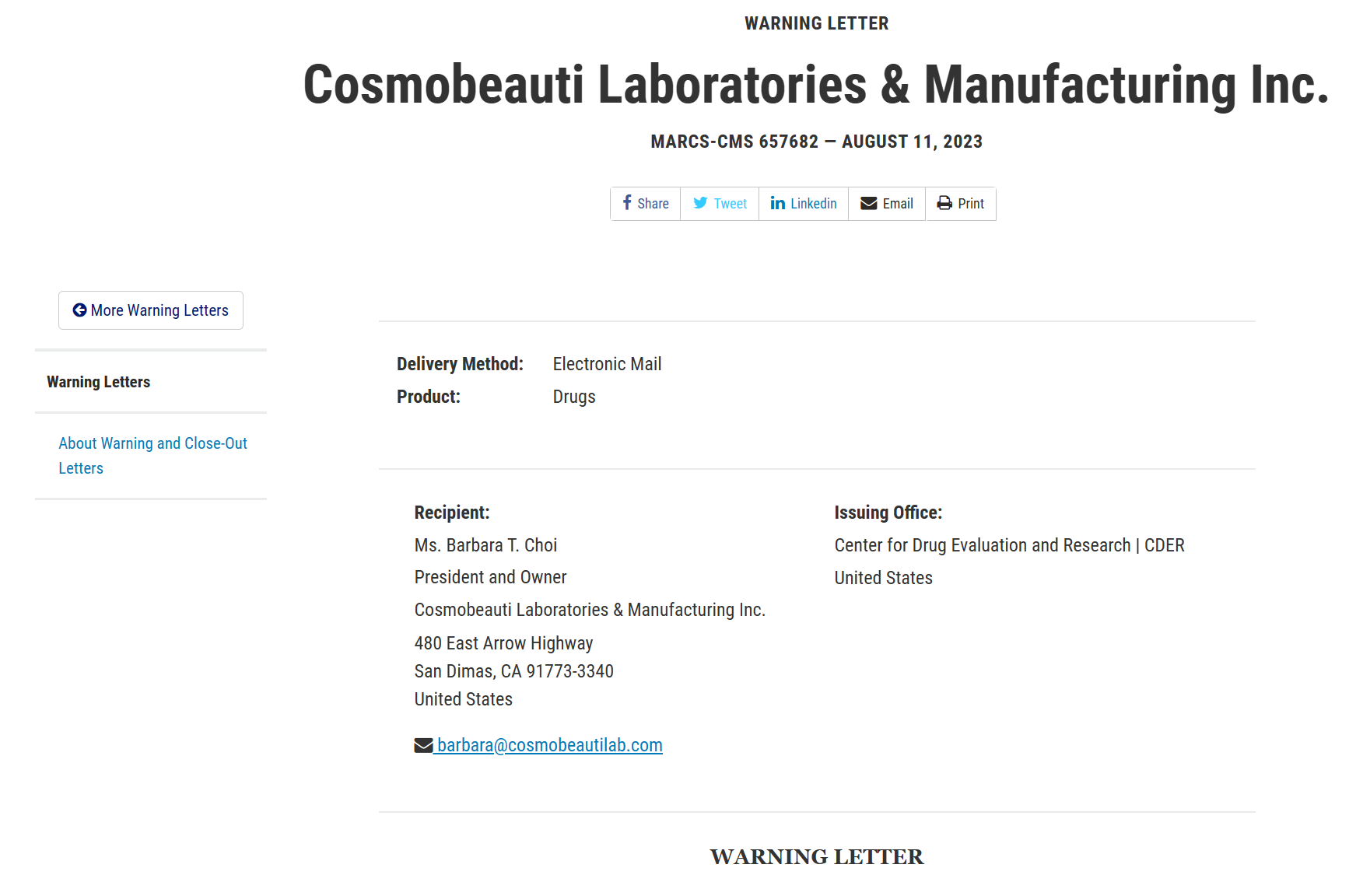
警告信中提到其严重违反了药品cGMP法规,详细情况如下:

警告信中指出,该公司在2017年已经接受了FDA的检查,并获得了类似的观察结果。现在,重复的调查结果表明该公司生产的质量监督和控制不符合cGMP规定。
观察到的调查结果产生了一系列数据完整性整改活动和CAPA措施的要求。这些所列要求的要点如下:

根据警告信中提到的最终结论,美国 FDA 强烈建议聘请一位 cGMP 顾问,以支持公司将其体系与 cGMP 要求对齐,并进行“全面六体系审计”。此外,美国 FDA 可能会暂停签发出口证书,并拒绝将该公司列为药品制造商的申请,直到其解决所有问题并完全符合 cGMP 的要求,这些要求可能会经过进一步的检查来验证。
要查看完整的违规列表和美国FDA给出的结论,请参阅警告信Cosmobeauti Laboratories & Manufacturing Inc.。
